По статистике в России рак груди встречается очень часто, и из всех онкологических заболеваний он занимает первое место. Это женское заболевание в основном встречается у взрослых женщин старше 55 лет. Но из-за ухудшения экологии в городах, из-за плохого питания опухоль молочной железы стала молодеть, и сейчас уже встречаются случаи у молодых девушек с 30 до 45 лет. В основном сами опухоли доброкачественные и быстро лечатся на первых стадиях.
Причины
Как и при любой онкологии, ученые и врачи до сих пор не могут найти точную причину развития злокачественных новообразований. Но есть несколько факторов, которые увеличивают шанс появления этого недуга.
Конечно же в первую очередь влияет здоровое состояние детородной системы. Есть ли сбои в менструальном цикле женщины и как именно они проходят. Сколько было родов, и как поздно они начались у женщины. А также длительность кормления ребенка грудью в период беременности.
Как и , так и злокачественная опухоль молочной железы напрямую зависит от уровня гормона в крови, а также как именно влияет сам эстроген на грудную железу. И чем выше уровень самого гормона относительно нормального значения, тем выше шанс заболеть. Давайте поподробнее рассмотрим все причины рака молочной железы.

Генетика
В прошлом столетии ученые открыли два гена, которые как раз и отвечают за мутацию молочных раковых клеток. Поэтому при наличии BRCA1 и BRCA2 гена, существенно повышает риск развития рака груди.
При этом сам рак проявляется довольно рано с 40 лет. Рак грудных желез появляется сразу в двух молочных мешках. Есть вероятность и появления других опухолей в матке, кишечнике или легких. Проявляются сразу несколько очагов и опухолей по всей молочной железе.
В каком возрасте чаще проявляется рак? Обычно это женщины старше 50 лет, у которых есть лишний вес и проблемы с питанием.
ПРИМЕЧАНИЕ! Оба этих гена влияют и на мужские органы — повышают шанс возникновения рака простаты.
Профилактика
Обычно многие женщины, при наличии этих генов, обращаются к решительным мерам и прибегают к хирургическому вмешательству. Удаление молочных желез правда уменьшают шанс на 95 %. Есть и те, кто удаляет яичники, так как они тоже входят в зону риска.
Внешние факторы
Как и при других опухолях на злокачественное женское образование влияет экология, радиация, облучение, ультрафиолетовые излучения, питание и загрязнение воздуха канцерогенами и мутагенами.
Ожирение очень сильно влияет на возникновение рака, так как сама жировая прослойка вырабатывает в кровь очень много женского гормона, который просто ядрами падает на молочные железы.
Радиация, общий радиационный фон в городе при превышении нормы сильно увеличивает риск, так как все Альфа, Бетта и Гамма лучи могут менять структуру ДНК клеток, а они в свою очередь мутируют.
Были случаи, когда при проведении радиотерапии для лечения другой онкологии у женщины возникал рак груди, и появлялись мелкие опухоли по всей зоне. Благо их сразу же удаляли до вступления в фазу метастазирования, но сам факт есть.
Другие факторы, влияющие на появление рака груди:
- Неправильная гормональная терапия, когда женщины занимаются самолечением без ведома и без консультации врача.
- Если у девушки очень рано началась менструация до 11 лет.
- Менопауза в преклонном возрасте.
- Нерожавшие женщины.
- Первая беременность после 30 лет.
Как знают многие, во время менструации женский организм испытывает большой прилив эстрогенов, из-за чего молочная железа подвергается опасности, но только если месячные протекают довольно долго. Проще говоря, чем дольше эстрагонные пики, тем хуже.
Влияют ли на рак груди оральные контрацептивы? На самом деле прямой опасности и доказательств этому нет. Некоторые врачи говорят, что при неправильном применении до 20 летнего возраста есть риск онкологического заболевания. Кто-то говорит, что они в комплексе опасны для женщины. Но в некоторых случаях эти препараты помогают женскому организму. Так что, при правильном применении этих препаратов, опасности нет!
Симптомы
К сожалению, но как и другие виды онкологии на первых порах грудная симптоматика никак себя не проявляет, и 1, 2 стадия — затишная. Сам рак на ранних этапах можно обнаружить только на УЗИ или на рентгенологической маммографии. В особенности это нужно делать женщинам после 50 лет и тем, кто входит в группу риска.
Первые признаки

- Болезненная менструация и резкое изменение настроения.
- Узловатое уплотнение в грудной зоне.
- Соски втягиваются.
- На груди появляется ямка.
- Появление апельсиновой корки в одной зоне.
- Покраснение в одном месте.
- Могут появляться язвы или корочки в одном месте. Особенно сильно это в сосковой зоне.
- Опухоль может деформировать грудь, и она становится не похожей на вторую.
- Лимфоузлы в подмышке увеличенные, плотные и безболезненные.
- Одна грудь может быть больше другой.
- Боль в одной молочной железе вне месячных.
- Сначала у больной появляется боль в суставе, а позже отекает вся конечность.
- Если злокачественные новообразования находятся близко к поверхности, то ее легко видно.
- Выделение неприятного на запах гноя или слизи.
- На более поздних стадиях повышается температура. Покраснения всей груди.
Если первые 12 симптомов могут характеризовать и другие болезни, то последние точно указывают на рак.
ПРИМЕЧАНИЕ! Если есть хоть один из признаков, то стоит обратиться к маммологу или врачу онкологу. Да само заболевание чаще всего протекает очень медленно и опухоль не агрессивна в начальных этапах, но и бывают случаи, когда рак развивался за несколько месяцев до последней смертельной стадии.
Разновидность
В первую очередь врач проводит полное обследование и выясняет, с чем он имеет дело: размер опухоли, степень поражения ближайших тканей, классификация и лимфатических узлов, уровень агрессивности, наличие метастазов в крови.
- Неинвазивные — если говорить проще, то это опухоль, которая не выходит за пределы своей ткани и структуры. При скором хирургическом вмешательстве, есть шанс сохранить большую часть груди.
- Инвазивный — Это уже другая форма, которая занимает по площади несколько тканей и структур. Более агрессивный и опасный вид рака.
- Плоскоклеточный рак молочной железы — обычно встречается гораздо чаще чем аденокорцинома. Происходит мутирование плоского эпителия.
- Аденокарцинома или железистый рак молочной железы — перерождается из железистого эпителия. Чаще встречается в нижней части груди.
Узловой рак груди
Этот вид на данный момент самый распространенный у женщин старше 40 лет. Опухоль на первых парах располагается в верхненаружных квадрантах груди. Далее сами клетки разрастаются и проникают в ближайшие ткани, мышцы, жировую прослойку и даже кожу.
Рак соска
По-другому эту патологию еще называют болезнью Паджета. Сначала сам сосок становится более плотным, а потом увеличивается в размере. Позже появляются заеды, сухие корочки. В общем сама болезнь очень медленная и поздно метастазирует.
Диффузный рак груди
Данный вид рака растет гораздо быстрее предыдущего, сами ткани более агрессивные, за счет чего опухоль быстро распространяется по всей молочной железе. Грудь вырастает в размере, имеет сильное покраснение и отек. Правда встречается он редко в 5 % случаев во всей грудной онкологии.
Чувствительность к гормону
Как мы и говорили, раковые опухоли в груди обычно имеют большую чувствительность именно к женским гормонам:
- Эстроген — ER+
- Прогестерон — PgR+
- Эпидермальный фактор роста HER+
Значит, если снизить количество гормонов, а также использовать препараты, которые снижают чувствительность самой опухоли — то можно снизить скорость роста злокачественных тканей или даже немного уменьшить само новообразование.
Но есть и такие типы рака, которые начинают развиваться без гормональной подпитки и никак не реагирует на количество женских гормонов в крови. Тогда врачам приходится прибегать к химиотерапии, чтобы уменьшить опухоль. Сама терапия имеет больше побочных последствий.
Вообще стадии рака молочной железы очень схожи и с другими злокачественными образованиями. Давайте рассмотрим подробнее.
| Этап | Разъяснение |
| 1 Стадия | Раковые клетки находятся в одной структуре ткани и не залазят на другие зоны. Опухоль имеет размер до 2 см. |
| 2 Стадия | Раковое новообразование уже начинает захватывать соседние ткани и клетки и прорастать в рядом стоящие локации. Но лимфатические узлы, кожа, жировая ткань — пока не поражены. Размер до 4,5 см. |
| 3 Стадия | Опухоль вырастает и становится больше 5 см и поражает мышцы, кожу и может прорастать в ткани межреберного пространства. Идет поражение подмышечных узлов. |
| 4 Стадия | Идет метастазирование в соседние органы и другую грудь. Позже клетки рака распространяются в первую очередь в кости, из-за чего появляются боли к суставах. В печень, когда появляется желтуха. Может поражать яичники и легкие. При сочетании рака груди и яичников, врачи могут сразу удалить второй орган. |

Обследование
В первую очередь вам будет необходимо сдать общий и биохимический анализ крови и в случае каких-либо отклонений врач может потребовать сдать кровь на онкомаркеры. Но делается это крайне редко, так как обычно при прямом подозрении опухоли в молочной железе терапевт уже отправляет на обследование к онкологу и маммологу.
Данное рентгеновское исследование необходимо делать всем женщинам раз в год после 50 лет, пациенткам входящих в группу риска раз в полгода, особенно тем, у кого есть гены BRCA1 и BRCA2.
Иммуногистохимическая диагностика
Врачи пытаются выяснить как реагируют опухолевые клетки на женский гормоны. Если сам РМЖ гормонозависимый, то назначаются определенные препараты, которые снижают чувствительность, а также снижают количество эстрогена в крови.
УЗИ
Для женщин старшего возраста данное обследование не очень подходит, и обычно применяется у молодых девушек. На ранних этапах есть сильная погрешность и шанс не выявить опухоль.
Цитологическое исследование
С помощью специального устройства врач берет образец тканей для исследования. Раковые клетки имеют другую структуру и на основе исследования можно определить, насколько сильно отличаются ткани от нормальных. Можно увидеть агрессивность и скорость роста клеток.
Другие исследования
Обычно назначают на более поздник стадиях рака, когда идут метастазы в другие органы, так врачам проще увидеть область поражения и назначить определенный тип лечения.
Терапия
Как и любое лечение онкологического заболевание зависит от стадии рака груди и возраста самой больной. Чем раньше была обнаружена патология груди, тем проще врачам провести лечение рака молочной железы. Терапия обычно направлена на удаление опухоли и части грудной железы, или полного удаления органа. Методов терапии довольно много, давайте разберем все.
Операция с частичным удалением
ПРИМЕЧАНИЕ! Врач обязательно назначает дополнительную терапию в виде облучения, для того чтобы убить оставшиеся раковые клетки. При удалении части железы или рака, сами здоровые половинки сшиваются.
Мастэктомия
Вы наверно уже догадались, что это идет полное удаление молочной железы с лимфатическими узлами.
Облучение
Лучевая терапия — это довольно действенный метод, после частичного удаления опухоли. Тогда врач назначает радиотерапию, чтобы уничтожить оставшийся раковые клетки, которые могут в последствии превратиться в рак.
Химиотерапия
Применяется как до, так и после операции. До хирургического вмешательства эта терапия помогает уменьшить размер и скорость роста, а после — применяют для уничтожения оставшихся очагов.
Гормонотерапия
У женщин пожилого возраста могут удалить яичники, чтобы они не выделяли лишний эстраген в кровь, плюс назначаются блокаторы, которые снижают чувствительность опухоли к женскому гормону.
Используют: тамоксифен, эксеместан, анастрозол, летрозол.
Паллиативная терапия
На 4 стадии, когда опухоль распространилась во все уголки организма, излечить недуг уже невозможно, и у врачей стоит задача улучшить качество жизни пациентки, снизить боли, интоксикацию и воздействие на органы самой опухолью. Для этого применяют облучение, химиотерапию, наркотические препараты, обезболивающее.
Лечение рака груди на 1 стадии
Обычно удаляется небольшая часть железы с опухолью. Так как нет сильного поражения ближайших тканей, то операция обычно проходит довольно успешно с небольшими последствиями. Если пациентка входит в группу риска, то дополнительно назначается радиотерапия.
Лечение рака груди 2 стадии
Здесь добавляется лечение препаратами, которые снижают скорость роста за счет гормоно-блокаторов. Плюс идет химиотерапия до операции, и после. Удаляется сама опухоль с ближайшими тканями. После операции пациентка проходит постоянное обследование на возникновение рецидивов.
Лечение рака груди 3 стадии
1 шаг — проведение химиотерапии, после чего проводится операция по частичному или полному удалению молочной железы. 2 шаг — приводится комплекс химио — и радиотерапии.
ПРИМЕЧАНИЕ! Помните — Раннее выявление рака способствует благоприятному прогнозу и более простому лечению.
Правила поведения после операции
- После операции нельзя спать, поэтому лучше чем-то отвлечь больную.
- Можно вставать и медленно ходить, если есть возможность.
- Нельзя трогать бинт и снимать его с грудной клетки.
- Аккуратно относитесь к полихлорвиниловой трубке, которая выводит наружу лишнюю сукровицу. Ее убирают после 8-11 дней.
- Если врач советует провести химиотерапию или облучение, то послушайте его, так как это позволит убить оставшиеся раковые клетки.
- Нельзя купаться в течение 3-4 недель.
- Швы снимают через две недели.
Послеоперационные осложнения
Сразу после операции
- Кровотечение из ран
- Нагноение
- Выделение лимфы
- Лимостаз
Поздние осложнения
- Нарушение осанки из-за удаления 1 груди. Для этого назначается ЛФК и совокупность различных упражнений, которые это исправляют.
- Постмастэктомический дефект — после того как удаляется одна железа, женщина чувствует себя не комфортно. Для этого устанавливается внутренний имплант или вешается специальный груз, который помогает уравновесить вторую грудь.
- При удалении соска и ареола обычно идет замена похожей тканью из половых губ, или из второго соска. Иногда сами ткани сшивают и рисуют ареол соска татуажем.
- Лимфатический отек руки — тогда врач назначает серию упражнения для снижения отека и улучшения кровообращения.
Психотерапия
После операция обычно женщина испытывает постмастэктомическую депрессию. При этом идет спад настроения, постоянная хандра, сексуальные проблемы из-за отсутствия одной груди. В этот период обязательно нужно ходить на курсы к психотерапевту, который поможет справится с этим этапом в жизни. Позже нужно будет вставить имплант для того, чтобы женщина чувствовала себя полноценной.
У мужчин
Как не странно, но рак молочной железы может посетить и представителей мужского пола. Дело в том, что у некоторых есть рудимент в виде молочной железы. Он конечно недоразвитый, но присутствует. Обычно рак груди у мужчин возникает при гинекомастии. Это происходит при сильном ожирении, когда идет избыток женских гормонов или из-за каких-то патологий.
При этом сама опухоль очень быстро растет и очень агрессивная. Из соска могут выделяться слизь и гной на последних стадиях. Лечения этой патологии очень тяжелое.
Прогноз
Карцинома выявляется на 2 и 3 стадии. Опухоль не агрессивная и медленно растет в самом начале. Именно поэтому процент выживаемости варьируется от 50 до 70 % в среднем по всем случаям.
- 1 Степени — 90 %
- 2 Степени — 70 %
- 3 Степени — 35 %
- 4 Степени — 5 % женщин проживают еще 5 лет.
Профилактика рака груди
- Женщины старше 55 лет должны ходить каждый год к маммологу.
Рак молочной железы (РМЖ, рак груди) – одно из самых частых злокачественных новообразований у женщин. По данным ВОЗ, в мире каждый год регистрируется около миллиона новых случаев опухоли. Чаще всего пациентки перешагнули 40-летний рубеж, однако, у молодых женщин это заболевание также может быть диагностировано. Редко, но все же возможно возникновение рака этой локализации и у мужчин, особенно, имеющих признаки гинекомастии (увеличения молочных желез) на фоне каких-либо гормональных нарушений.
Практически каждая женщина, так или иначе, сталкивалась с теми или иными изменениями в молочной железе. В молодом возрасте наиболее распространены дисгормональные процессы и доброкачественные опухоли, а на долю рака приходится не более 5% случаев. В период менопаузы и после ее наступления риск развития рака значительно возрастает, поэтому возрастная категория пациенток с опухолью – 50-70 лет.
Молочная железа, помимо основной функции – лактации в период грудного вскармливания детей – важна и с позиций эстетики и внешнего вида женщины, поэтому любые проблемы, а особенно оперативные вмешательства, сопровождающиеся удалением органа, приносят немалый психологический дискомфорт. Нередки случаи тяжелых депрессий после радикальных операций на груди. Чтобы избежать подобных последствий, необходимо трепетное и внимательное отношение к своему здоровью, а регулярные медицинские осмотры чрезвычайно важны для своевременного выявления заболевания.
Рак груди является одним из наиболее изученных типов опухолей человека, а исследования механизмов его возникновения и способов борьбы с болезнью продолжаются и по сей день.
Первые сведения об этом коварном заболевании были обнаружены еще в древнеегипетских папирусах. Тогда опухоль прижигали, а о метастазировании не знал никто, поэтому болезнь всегда заканчивалась смертью. С развитием медицины пришло осознание возможности распространения опухоли по лимфатической и кровеносной системе, что отражалось в многочисленных наблюдениях. Удаление вместе с опухолью и регионарных лимфатических коллекторов стало настоящим прорывом на пути к действительно эффективному лечению рака.
Сегодня наука обладает бесценными знаниями в области причин, диагностики и эффективного лечения злокачественных опухолей. Однако, несмотря на положительные результаты современной медицины, частота запущенных форм остается высокой (до 40%). Такая печальная статистика обусловлена низкой информированностью населения о первых симптомах болезни и способах самообследования. Часто сами женщины игнорируют посещение женской консультации или врача-маммолога, ссылаясь на занятость, откладывая визит на неопределенный срок и т. д.
Во многих странах, в том числе и на постсоветском пространстве, отсутствуют принятые обязательные скрининговые программы, направленные на массовое обследование большого количества лиц группы риска (женщины после 40 лет). Широкий охват таким исследованием как маммография позволил бы диагностировать значительно больше ранних форм опухоли молочной железы, и, соответственно, добиться лучших результатов терапии.
Известно, что при раннем выявлении злокачественного новообразования молочной железы добиться полного излечения возможно более чем в 95% случаев, а смертность при этом уменьшается как минимум на треть.
Почему появляется рак?
Любая женщина, столкнувшаяся с проблемой рака груди, задается вопросом: почему опухоль возникла именно у нее? Какие были для этого причины и можно ли было избежать болезни?
Сегодня известны и изучены факторы риска, которые в значительной степени способствуют развитию рака:
- Генетическая предрасположенность, неблагоприятный семейный анамнез;
- Рано начавшиеся менструации и позднее наступление менопаузы;
- Отсутствие или поздние первые роды;
- Доброкачественные поражения паренхимы молочной железы;
- Изменения обмена веществ и патология эндокринной системы;
- Длительный прием гормоносодержащих препаратов;
- Наличие мутаций генов BRCA1 и BRCA2.
Давно замечено, что у женщин, чьи мамы или бабушки страдали злокачественными опухолями молочной железы, вероятность развития рака намного выше, что позволило сделать выводы о наличии семейной предрасположенности к заболеванию .
Поскольку молочная железа – гормонозависимый орган, то есть имеющий рецепторы к женским половым гормонам, то любые нарушения со стороны эндокринной системы , в общем, и половых органов, в частности, способствуют патологии. Раннее начало и позднее окончание менструальной функции, нарушения в работе гипоталамо-гипофизарно-яичниковой системы, аборты, ранние и многочисленные роды либо их отсутствие, заболевания яичников способствуют гормональным перестройкам, которые вызывают нарушение процессов размножения клеток и гиперплазию железистой ткани, что становится основой развития мастопатий.
Помимо дисгормональных расстройств, появлению злокачественной опухоли молочной железы способствуют ожирение, сахарный диабет, артериальная гипертензия, патология щитовидной железы и печени.
Среди внешних причин, увеличивающих риск развития злокачественной опухоли молочной железы, особая роль отводится курению, воздействию канцерогенных веществ, содержащихся в продуктах питания и средствах бытовой химии, погрешностям в питании с преобладанием жирной пищи, а также ионизирующему излучению.
Длительный прием гормональных препаратов, назначаемых для регуляции менструального цикла, лечения бесплодия, а также в постменопаузе у женщин с патологией эндометрия также может в какой-то степени повышать вероятность возникновения опухоли. Однако в последние годы этот вопрос дискутируется, а новые данные касательно современных лекарственных средств отрицают наличие такого риска.
Особое место среди причин рака различных локализаций отводится генетическим нарушениям. Успехи современной молекулярной генетики позволили выделить ряд генов, мутации которых наиболее часто встречаются при тех или иных новообразованиях. Такие механизмы канцерогенеза очень убедительно продемонстрированы в отношении опухолей молочной железы. Доказано, что носительницы мутантных генов BRCA1 и BRCA2 имеют высокую вероятность развития опухоли, при этом ген BRCA1 также связывают с риском рака яичников. Таким образом, ген рака молочной железы известен, а его обнаружение доступно в крупных клиниках при помощи современного оборудования.
соотношение числа случаев рака МЖ и выявленных наследственных факторов
Обследование женщин групп риска лежит в основе онкогенетического консультирования, направленного на выявление наследственной предрасположенности к злокачественным новообразованиям молочной железы среди близких родственников больных женщин, а также среди тех, чьи мамы или бабушки имели опухоль. Известны случаи, когда женщины, у которых были обнаружены описанные мутации, заблаговременно прибегали к удалению молочных желез, не дожидаясь развития рака.
Предопухолевые процессы в молочной железе
Основное место среди предопухолевых изменений в ткани молочной железы отводится гиперпластическим процессам, объединенным в группу мастопатий. Часто такая патология рассматривается как предраковый процесс.
признаки потенциально предраковых изменений груди
Мастопатия представляет собой гиперпластические изменения, сопровождающиеся пролиферацией и увеличением доли железистого компонента по отношению к стромальному. Иначе говоря, масса железистой ткани в виде долек увеличивается. При этом нередки явления дисплазии эпителия, сопровождающейся нарушением дифференцировки клеток с появлением признаков, свойственных злокачественным опухолям. Мастопатию, или фиброзно-кистозную болезнь, относят к дисгормональным заболеваниям, возникающим при нарушении эндокринной функции, патологии женских половых органов. Частые аборты, прием гормональных препаратов, обменные факторы, в частности ожирение, весьма способствуют подобного рода изменениям. Наиболее подвержены мастопатии женщины молодого возраста, а по разным данным, признаки ее можно обнаружить более чем у половины женского населения земного шара.
Фиброзно-кистозная болезнь характеризуется болезненностью, увеличением объема молочной железы, неравномерным уплотнением ткани. Процесс может носить как диффузный характер, так и очаговый с образованием узлов и кист на ограниченных участках органа. Во всех случаях при морфологическом исследовании определяются участки избыточной пролиферации эпителиального компонента, увеличение количества долек и междольковой соединительной ткани, а также явления дисплазии. Хотя мастопатия и является доброкачественным процессом, но все же наличие дисплазии эпителия делает ее опасным состоянием в отношении перспективы малигнизации ее очагов.
Своевременная диагностика и лечение предшествующих фиброзно-кистозной болезни изменений гормонального фона способны в значительной степени уменьшить вероятность появления рака в последующем.
Помимо мастопатии, возможно обнаружение и доброкачественной опухоли молочной железы – папилломы или аденомы , состоящих из эпителия, выстилающего протоки или образующего ее дольки, а также фиброаденомы, имеющей смешанное эпителиально-соединительнотканное строение. Фиброаденома часто встречается у молодых девушек в виде одиночного плотного узла, сама по себе опасности не представляет при своевременной диагностике и удалении.
Виды злокачественных опухолей груди
Существуют различные подходы к классификации злокачественных опухолей молочной железы, а решающее значение в определении лечебной тактики и прогноза имеют локализация, размеры, степень дифференцировки и гистологический тип рака, особенности роста и наличие рецепторов к женским половым гормонам эстрогенам.
По характеру роста опухоли в паренхиме рак бывает:
- Узловой – в виде ограниченного узла в толще железы;
- Диффузный – прорастает ткань органа, не имеет четких границ.
Возможны атипичные формы роста – рак Педжета, первично-метастатический рак.
Размеры первичного ракового узла часто отражают степень его злокачественности. Чем больше опухоль, тем она агрессивнее и прогностически неблагоприятнее.
распределение локализаций опухоли
Локализация определяет стадии метастазирования по путям лимфооттока. Местонахождение опухоли характеризуется соответствующим квадрантом – фрагментом ткани, получающимся, если схематически разделить железу на четыре равные части.
Гистологические типы рака молочной железы выделяют в зависимости от источника роста:
- Протоковый рак, возникающий из эпителия млечных ходов;
- Дольковый рак, источником которого становятся железистые клетки долек.
Инвазивный рак молочной железы может быть как дольковым, так и протоковым, и подразумевает проникновение опухоли сквозь базальную мембрану, на которой располагаются эпителиальные клетки. Такой тип роста делает его более агрессивным и склонным к метастазированию.
протоковая карцинома (слева) и дольковая карцинома (справа) – виды рака молочной железы с точки зрения гистологии
Среди гистологических вариантов злокачественных опухолей молочной железы наиболее распространены аденокарцинома (железистый рак), солидный рак (вариант недифференцированного) и переходные формы. Такая классификация сложна и необходима врачам онкологам-маммологам.
Ранний рак представляет собой начальный этап развития опухоли, когда происходит распространение клеток за пределы базальной мембраны, но не глубже 3 мм. Как правило, этой стадии не свойственно метастазирование, поскольку отсутствуют сосуды, а прогноз почти всегда достаточно благоприятный.
Как и для других злокачественных новообразований разработана классификация РМЖ по системе TNM, характеризующей особенности первичной опухоли и метастазов. Учитывая возможные сочетания проявлений по TNM определены четыре стадии рака молочной железы:
- I стадия – опухоль не более двух сантиметров в диаметре, прорастания в окружающую ткань и метастазов нет;
- II стадия (a, b) – опухоль 2-5 см, возможно врастание в окружающую ткань и поражение регионарных лимфатических узлов;
- IIIa, IIIb – опухоль больше пяти сантиметров, прорастающая окружающие ткани, наличие лимфогенных метастазов в подмышечных лимфоузлах и за их пределами;
- IV стадия – выявлены отдаленные метастазы вне зависимости от размеров первичной опухоли и поражения лимфоузлов.
Метастазирование
Метастазирование считается неотъемлемым компонентом практически всех злокачественных опухолей. Рак молочной железы – не исключение. Лимфогенные метастазы выявляются почти во всех случаях, и такой путь распространения опухоли реализуется довольно рано. В более поздних стадиях возможно обнаружение распространения опухоли и по кровеносным сосудам.
Характер поражения конкретных групп лимфоузлов определяет стадию заболевания, а также существенно сказывается на объеме операции при последующем хирургическом лечении. В связи с этим, выделяют регионарное (в подмышечные, подлопаточные, под- и надключичные, а также парастернальные лимфоузлы, располагающиеся по ходу грудины) и отдаленное метастазирование (в подмышечные и надключичные с противоположной опухоли стороны, средостенные и лимфоузлы брюшной полости).
Локализация метастазов зависит также и от расположения злокачественного новообразования в паренхиме железы. Так, при ее нахождении в верхне-наружном квадранте, одними из первых поражаются подмышечные лимфатические узлы. Иногда такие метастазы обнаруживаются раньше самой первичной опухоли при небольших ее размерах и отсутствии клинических проявлений.
Гематогенный путь распространения рака характерен для более поздних стадий, когда злокачественная опухоль врастает в кровеносные сосуды. Раковые клетки разносятся с током крови в различные органы – головной мозг, кости, печень, противоположную железу и т. д.
В некоторых случаях, метастазы могут проявить себя через много лет после проведения радикальной операции. Так, известны случаи, когда поражение мозга вторичными опухолевыми узлами возникало через 10-15 лет после эффективного лечения. В такой ситуации мнимое благополучие может закончиться фатально в достаточно короткие сроки.
Проявления рака молочной железы
Проявления злокачественных опухолей молочной железы не отличаются разнообразием, однако, долгое время заболевание может оставаться незамеченным со стороны женщины. В случае, когда опухоль не достигла 2-3 см, а молочная железа содержит значительное количество жировой ткани, самостоятельное обнаружение рака может быть затруднительно.
Как правило, пациентки сами обращаются к специалисту, обнаружив у себя уплотнение либо другие изменения груди. Нередко новообразования выявляются при профосмотрах и даже случайно на консультациях в связи с другими заболеваниями.
Наиболее частые симптомы рака молочной железы:
- Пальпируемое узловатое образование либо диффузное увеличение железы, изменение ее формы и консистенции;
- Появление изъязвлений на коже, в околососковом поле или соске;
- Выделения из соска, чаще кровянистого характера;
- Дискомфорт в подмышечной области вследствие увеличения лимфатических узлов.
Клинические особенности течения позволяют выделить следующие формы рака:
- Узловая;
- Диффузная (маститоподобный, панцирный рак и др.);
- Атипические варианты (рак Педжета).
Узловой вариант характеризуется ростом образования в виде ограниченного узла, часто плотной консистенции и безболезненного на ощупь. По мере того, как увеличиваются размеры опухоли, появляются изменения кожи – морщинистость, уплотнение, возможно втяжение соска, деформация груди. Прорастание кожи сопровождается изъязвлением и присоединением вторичного воспаления.
С увеличением размеров новообразования, нарушается и подвижность молочной железы. В далеко зашедших стадиях, когда рак прорастает грудную стенку, опухоль становится неподвижной.
Для определения локализации рака, а также его связи с кожей, соском, грудной стенкой необходимо тщательное пальпаторное исследование молочной железы в разных положениях.
Диффузная форма рака молочной железы представлена четырьмя основными разновидностями:
- Отечно-инфильтративный рак;
- Маститоподобный;
- Рожистоподобный;
- Панцирный рак.
Отечно-инфильтративный вариант течения рака молочной железы чаще встречается среди молодых женщин, в период беременности и лактации. Для этой формы характерно значительное увеличение объема, отек ткани, уплотнение железы, изменение цвета кожных покровов, появление симптома «лимонной корки» вследствие поражения раковыми клетками лимфатических сосудов. Как правило, наблюдается раннее метастазирование.
Маститоподобный рак также чаще встречается среди женщин молодого возраста. Проявления его в начальной стадии сходны с воспалительным процессом в молочной железе – маститом, поэтому случаи запоздалой диагностики нередки. Клиническая картина складывается из повышения температуры тела, появления признаков общей интоксикации на фоне изменений в органе в виде увеличения размера, появления диффузного или очагового уплотнения, отека, боли, покраснения кожи в месте роста новообразования. Злокачественная опухоль бурно прогрессирует, довольно рано можно обнаружить появление метастазов. При такой форме рака важно вовремя заподозрить возможность злокачественного роста, особенно у женщин, кормящих грудью и склонных к маститу.
некоторые виды рака молочной железы
Рожистоподобный рак , помимо уплотнения ткани молочной железы, проявляется своеобразными кожными изменениями, похожими на рожистое воспаление. Кожа над пораженным участком становится горячей на ощупь, появляется покраснение с неровными очертаниями, которое может распространяться на значительную площадь, выходя за пределы железы. Возможно повышение температуры тела, изъязвление гиперемированных участков, присоединение вторичной инфекции. Весьма характерным является поражение раковыми клетками лимфатических сосудов и метастазирование в регионарные лимфоузлы. Ошибочная диагностика с назначением противовоспалительного и физиотерапевтического лечения при этой форме рака может привести не только к потере времени, но и спровоцировать более быстрый рост опухоли.
Панцирный рак получил свое название вследствие характерного для этой формы внешнего вида молочной железы. Новообразование, растущее из железистой ткани, поражает кожные покровы и жировую клетчатку, а молочная железа уменьшается в размерах и деформируется, кожа над ней становится плотной и напоминает панцирь. Патологический процесс может распространиться на грудную стенку или вторую железу. Течение панцирного рака весьма неблагоприятное.
Атипическим вариантом злокачественной опухоли молочной железы считается рак Педжета, поражающий сосок и ареолу. Источником новообразования является эпителий протоков, откуда неоплазия прорастает в кожу и распространяется в дерме. На ранних стадиях опухолевый узел не обнаруживается, а на первый план выходит поражение соска и ареолы. Характерными признаками являются гиперкератоз (избыточное образование роговых масс) с появлением чешуек и шелушения, покраснение и изъязвление кожи соска и ареолы, возможен зуд. По мере роста опухоли сосок деформируется и подвергается деструкции. Клинические проявления этой формы рака сходны с экземой или псориазом, что может быть причиной неправильной и запоздалой диагностики.
Любые изменения молочной железы, даже самые незначительные, должны быть поводом для обращения к врачу, поскольку чем раньше будет установлен правильный диагноз, тем эффективнее пройдет последующее лечение.
Особое внимание следует уделять молодым женщинам и кормящим мамам, у которых злокачественные опухоли растут очень быстро и склонны к раннему метастазированию. У пациенток пожилого возраста рак может развиваться годами, не проявляя признаков распространения даже в регионарные лимфоузлы. Таким образом, течение заболевания зависит от возраста женщины, формы рака, наследственных факторов и своевременности постановки верного диагноза.
Видео: признаки рака груди в программе “Жить здорово!”
Диагностика
Возможности эффективной борьбы с болезнью целиком и полностью зависят от того, в какой стадии будет выявлено новообразование. Ранняя диагностика рака молочной железы может быть затруднительна, особенно, если женщина не проводит регулярное самообследование. Однако эффективным может стать обследование, по крайней мере, женщин из группы риска, имеющих неблагоприятный семейный анамнез, нарушения гормонального фона, те или иные формы предопухолевых процессов молочной железы, патологические изменения матки и яичников. Также в группу риска можно отнести женщин старше 35 лет.
При обращении к врачу, обязательно будет проведено пальпаторное исследование груди, позволяющее определить наличие или отсутствие уплотнений или опухолевых узлов, смещаемость железы в разных положениях пациентки, наличие деформации, изменений сосков и т. д.
После осмотра, помимо общеклинических исследований (общий и биохимический анализы крови, мочи и т. д.), будут назначены специальные диагностические процедуры для обнаружения опухоли.
Основными способами обнаружения рака молочной железы являются:
- Маммография (рентгенологичекий метод);
- Ультразвуковое исследование;
- Пункционная биопсия.
При дальнейшем уточнении диагноза могут быть использованы КТ, МРТ, рентгенография легких, сцинтиграфия костей, УЗИ органов брюшной полости, позволяющие также выявить наличие и локализацию метастазов.
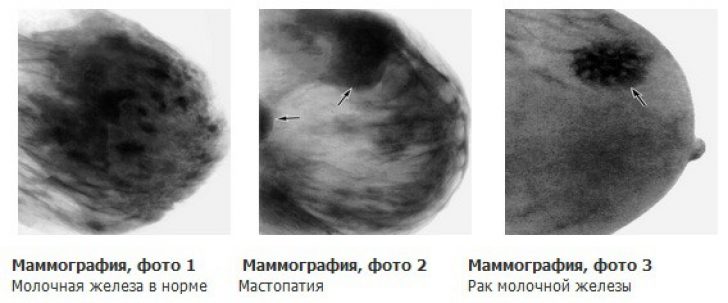
Маммография относится к рентгенологическим методам исследования и в ряде стран является скрининговым для женщин старше 40 лет. Этот метод по праву считается «золотым стандартом» в диагностике рака молочной железы, а достоверность полученных данных доходит до 95%. Маммографию проводят с помощью специальных аппаратов – маммографов, позволяющих выявить достаточно небольших размеров опухоль при минимальной лучевой нагрузке.
проведение маммографии
На маммограммах возможно обнаружить опухолевидное образование в ткани железы, изменения со стороны кожи, лимфатических и кровеносных сосудов, а также участки отложения солей кальция, возникающие достаточно рано при наличии раковой опухоли. Кальцинаты можно считать одним из достоверных показателей злокачественности патологического процесса.
При необходимости маммография может быть дополнена дуктографией с введением рентгеноконтрастного вещества в просветы протоков.
Ультразвуковое исследование также является высокоинформативным, особенно у молодых женщин, беременных или кормящих грудью. Поскольку у молодых в ткани молочной железы содержится больше жидкости и грудь имеет большую плотность, то УЗИ подчас дает больший объем информации, нежели маммография. Кроме того, этот метод безвреден, поэтому может проводиться, в том числе, беременным, а информативность при некоторых формах рака достигает 100%.
Во всех случаях наличия опухолевидного образования в ткани молочной железы обязательно проводится пункционная биопсия, а в последующем – цитологическое и гистологическое исследование полученной ткани. Забор фрагментов опухоли под контролем УЗИ или маммографа позволяет произвести взятие материала строго из пораженного участка, исключая, тем самым, возможные диагностические ошибки.
В крупных медицинских центрах, оснащенных современным рентгеноцифровым оборудованием, возможно проведение стереотаксической биопсии, позволяющей произвести забор материала практически со 100%-ной точностью.
Гистологическое исследование фрагментов опухолевой ткани позволяет не только определить конкретный вариант рака, но и наличие рецепторов к половым гормонам, что очень важно в выборе дальнейшей тактики лечения.
Все большую популярность приобретают исследования – специфических белков, ферментов, гормонов, количество которых увеличивается при определенных злокачественных опухолях. Такой метод позволяет заподозрить рак еще до того, как можно будет его обнаружить другими доступными способами.
В целях диагностики рака молочной железы проводится анализ на онкомаркер СА 15-3 – белок, содержание которого в крови увеличивается при появлении опухоли. Важно также следить за изменением его уровня в динамике, поскольку нарастание концентрации может быть следствием не только увеличения размеров злокачественной опухоли, но и признаком начавшегося метастазирования.
Развитие молекулярной генетики делает доступными также и генетические исследования предрасположенности к раку, в частности, определение носительства мутаций генов BRCA1 и BRCA2. Некоторые женщины, получив положительный результат, прибегают к удалению обеих молочных желез, не дожидаясь развития рака, что может быть в таких случаях весьма эффективной профилактикой опухоли.
Видео: самообследование и пальпация у врача при раке груди
Особенности терапии рака груди
Лечение рака молочной железы состоит в сочетании хирургического, химиотерапевтического методов воздействия, а также облучения. Выбор конкретной тактики всегда определяется стадией заболевания, размерами опухоли и наличием или отсутствием метастазов. Наилучшие результаты дает лечение ранних форм рака.
Хирургический метод по-прежнему остается основным в случае злокачественных опухолей молочной железы. Наиболее распространенные виды операции – радикальная мастэктомия по Холстеду, лампэктомия, резекция квадранта молочной железы.
Наиболее радикальной и в то же время самой травматичной является мастэктомия по Холстеду, подразумевающая удаление самой железы с опухолью, грудных мышц, клетчатки и лимфоузлов. Применяется такой вид лечения в запущенных тяжелых случаях, а серьезный косметический дефект требует в последующем коррекции с помощью различных пластических операций.
Лампэктомия – современный и щадящий метод лечения, применимый для опухолей первой и второй стадии. При этом происходит удаление опухоли и окружающей ткани в пределах двух сантиметров, а подмышечные лимфоузлы извлекаются через отдельный разрез. Эта операция дает хороший косметический результат, позволяя сохранить хотя бы частично ткань железы. Лампэктомия требует высокой квалификации и точности оперативной техники со стороны хирурга.
Резекция квадранта молочной железы подразумевает удаление четверти органа, в которой располагается небольших размеров опухоль, и через отдельный разрез лимфатических узлов. Такая операция дополняется химиолучевой терапией из-за возможности рецидива опухоли и дает достаточно хороший результат, подчас не уступая по эффективности более радикальным и травматичным вмешательствам.
Поскольку удаление рака молочной железы сопровождается нарушением внешнего вида органа, приносящим существенный психологический дискомфорт женщине, то в большинстве случаев к лечению привлекаются пластические хирурги, замещающие дефект собственными тканями пациентки либо искусственными имплантами.
При хирургическом лечении происходит удаление первичного очага опухолевого роста, однако это не защищает от возможности распространения неоплазии за пределы локализации новообразования. Химиотерапия при раке молочной железы направлена на уничтожение злокачественных клеток, покинувших орган и являющихся источником метастазов в будущем.
Наиболее эффективными препаратами являются адриамицин, циклофосфан, метотрексат и другие. Такое лечение, попросту называемое «химия», является достаточно токсичным и требует назначения поддерживающей терапии (гепатопротекторы, витамины, антиоксидантные комплексы).
Лучевая терапия применяется для того, чтобы снизить вероятность рецидива опухоли после ее удаления. В тяжелых случаях, когда извлечение новообразования невозможно, облучение призвано облегчить страдания пациенток (паллиативное лечение). Если отдаленные метастазы вызывают серьезные нарушения (в головном мозге, например), то их также можно подвергнуть радиовоздействию.
Во всех случаях необходимо адекватное обезболивание и поддержка функции других органов, особенно, при наличии метастазов и выраженной интоксикации.
Питание при раке молочной железы не имеет каких-либо существенных особенностей, однако в послеоперационном периоде следует избегать трудноусвояемой и тяжелой пищи. На всех этапах лечения полезно употреблять овощи, фрукты, зелень, крупы, содержащие большое количество витаминов, микроэлементов и естественных антиоксидантов.
Народные средства пользуются большой популярностью, особенно в тех случаях, когда больные пытаются зацепиться хоть за какую-то «соломинку» либо не доверяют традиционной медицине и врачам. В целях лечения рака молочной железы применяют настои грецкого ореха, крапивы, отвары из корня лопуха, валерианы и даже мухоморов. Стоит помнить, что действительно эффективным может быть только лечение у доктора с помощью современных методов борьбы с раком, а народная медицина имеет право на существование в качестве дополнения. Во всех случаях, когда планируется употребление того или иного растительного средства, нужно обязательно обсудить этот вопрос с лечащим врачом, чтобы не нанести еще больший вред их применением.
Продолжительность жизни после лечения злокачественных опухолей молочной железы зависит от того, на какой стадии было обнаружено заболевания. При ранних формах до 95% пациенток выживают при относительно хорошем прогнозе. Запущенным больным остается лишь два-три года жизни.
В части случаев успешного лечения рака могут быть такие неблагоприятные последствия, как появление отдаленных метастазов через много лет после операции. Об этом необходимо помнить и регулярно посещать врача для контроля за состоянием пациентки.
Как предотвратить рак?
Часто женщины задаются вопросом: возможна ли профилактика рака молочной железы? Да, возможна. Более того, необходимы и собственные усилия представительниц прекрасного пола. Регулярное самообследование, которое доступно всем без исключения, должно быть нормой для женщин, заботящихся о своем здоровье. После сорока лет ежегодно следует проходить маммографию, а при появлении хоть каких-то, даже кажущихся незначительными, изменений – сразу же обращаться к врачу.
Самообследование является достаточно эффективным способом личной профилактики. Для его проведения необходимо осматривать в зеркале молочные железы, обращая внимание на изменения формы, контуров, цвета кожи, появление деформации и т. д. В положении лежа круговыми движениями можно ощупать всю толщу железы, изучая ее консистенцию и однородность паренхимы. Слегка надавив на сосок, нужно убедиться в отсутствии выделений.
Здоровый образ жизни, отсутствие вредных привычек, правильно подобранное белье, своевременные роды и кормление грудью являются теми неспецифическими факторами, которые также помогают избежать злокачественных опухолей груди.
Отдельно стоит отметить, что в редких случаях возможно возникновение рака молочной железы и у мужчин, особенно, страдающих ожирением и эндокринной патологией, поэтому любые изменения должны насторожить и стать поводом для консультации у специалиста.
Вопрос вероятности возникновения рака молочной железы у кошек и собак, подчас становящихся практически членами семьи, волнует также их владельцев. Известно, что среди всех опухолей у домашних питомцев, рак указанной локализации занимает третье место, чаще поражая кошек. Хозяева животных при появлении подозрений на такое заболевание могут обратиться к ветеринарам, которые предложат, в том числе, и оперативные методы лечения, позволяющие сохранить жизнь своим пушистым любимцам.
Видео: лечение и профилактика рака груди
Автор выборочно отвечает на адекватные вопросы читателей в рамках своей компетенции и только в пределах ресурса ОнкоЛиб.ру. Очные консультации и помощь в организации лечения в данный момент, к сожалению, не оказываются.
Председатель Российского общества клинической онкологии,
заведующий отделением клинической фармакологии и химиотерапии,
заместитель директора по научной работе
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, профессор,
Москва
У большого числа больных рак молочной железы возникает в пожилом возрасте. С развитием ранней диагностики все большее число заболеваний выявляется в ранних стадиях, что позволяет выполнить радикальную резекцию вместо радикальной мастэктомии. Однако больным после радикальной резекции необходимо проведение лучевой терапии на оставшуюся ткань молочной железы. Эта процедура небезопасна при наличии сопутствующей патологии сердечной мышцы (атеросклероз с нарушением кровоснабжения сердечной мышцы, уменьшение сократительной функции миокарда и другие), особенно если речь идет о лучевой терапии на левую молочную железу. Одновременно, рак молочной железы у пожилых протекает менее агрессивно и часто сочетается с наличием рецепторов стероидных гормонов в опухоли. В этом случае гормональная терапия может успешно элиминировать как отдаленные микрометастазы, так и рост опухолевых клеток в зоне операции. Проведенные исследования по изучению роли лучевой терапии после радикальной резекции исключали больных старше 70 лет, поэтому невозможно экстраполировать полученные результаты у молодых на пожилых пациенток. В связи с эти представляется актуальным изучение роли адъювантной лучевой терапии молочной железы в случае выполнения радикальной резекции у больных пожилого возраста.
В исследование PRIMEII было включено 1326 больных раком молочной желез в возрасте старше 65 лет с низким риском (отсутствие метастазов в подмышечных лимфоузлах, наличие рецепторов стероидных гормонов, Т1 или Т2 до 3 см в максимальном размере, отсутствие опухолевых клеток в краях резекции, разрешалась либо степень дифференцировки опухоли 3 либо наличие лимфоваскулярной инвазии, но не оба признака вместе) после выполнения радикальной резекции. Все больные должны были получать адъювантную гормонотерапию. Больные рандомизировались в группу наблюдения или в группу лучевой терапии на оставшуюся часть молочной железы (40-50 Гр за 15-25 фракций). Основным критерием эффективности была частота локального рецидива в прооперированной молочной железе.
Согласно рандомизации 668 больных получали только адъювантную гормонотерапию, у 658 больных к проводимой гормонотерапии добавляли лучевую терапию. Группы были сравнимы по своим демографическим характеристикам и свойствам опухолевого процесса. При медиане наблюдения 5 лет частота рецидива в оперированной молочной железе после проведенной лучевой терапии и без составила 1,3% и 4,1% соответственно (HR=5,19, р=0,0007). Абсолютное уменьшение 5-летней частоты локального рецидива составило 2,9%. Для того чтобы предотвратить один случай локального рецидива, необходимо выполнить лучевую терапию у 32 больных. В случае возникновения локального рецидива (31 больная) мастэктомия и широкая резекция была выполнена у 14 и 13 больных соответственно. Частота отдаленных метастазов, рака в контралатеральной молочной железе и случаев рака других локализаций была одинакова в обеих группах. При проведении многофакторного анализа было показано, что только отсутствие лучевой терапии было единственным фактором, предсказывающим возникновение локального рецидива. При проведении внепланового анализа было показано, что риск локального рецидива повышался у больных с низким содержанием рецепторов стероидных гормонов в опухоли.
Общая 5-летняя выживаемость составила 93,9% для обеих групп. Зарегистрировано 89 смертей, 12 из которых были следствием прогрессирования рака молочной железы: у 8 (16%) из 49 больных в группе наблюдения и у 4 (10%) из 40 больных в группе лучевой терапии.
Проведенное исследование четко продемонстрировало важную роль облучения оставшейся части молочной железы в снижении частоты локального рецидива. Радикальная резекция с последующей адъювантной гормонотерапией и лучевой терапией позволяет добиться прекрасного местного контроля: частота локального рецидива составляет только 1,3%. Отказ от проведения лучевой терапии увеличивает частоту локального рецидива до 4,1%. Достаточно ли этой цифры для того, чтобы отказаться от проведения лучевой терапии у больных пожилого возраста? Авторы считают, что да. При этом делается замечание, что такой отказ нежелателен у больных с низким содержанием стероидных рецепторов в опухоли. Низкая частота локального рецидива и возможность его хирургического удаления не оказывают влияния на общую продолжительность жизни. Большинство смертей в группе больных старше 65 лет наблюдается от причин, не связанных с прогрессированием рака молочной железы. Поэтому отказ от поголовного проведения лучевой терапии у больных раком молочной железы старше 65 лет с низким риском прогрессирования не ухудшит отдаленные результаты лечения и позволит существенно уменьшить нагрузку на существующие отделения лучевой терапии. Кроме того, в настоящее время больным пожилого возраста с Т1-2 часто отказывают от выполнения резекции и выполняют мастэктомию из-за необходимости последующей лучевой терапии. Теперь это объяснение не может служить оправданием расширения объема оперативного вмешательства.
Ключевые слова: рак молочной железы, радикальная резекция, адъювантное облучение молочной железы.
Литература:
- Kunkler IH, Williams LJ, Jack WJL, et al. Breast-conserving surgery with or without irradiation in women aged 65 years or older with early breast cancer (PRIME II): a randomized controlled trial. Lancet Oncology 20015, 16:266-73.
480 руб. | 150 грн. | 7,5 долл. ", MOUSEOFF, FGCOLOR, "#FFFFCC",BGCOLOR, "#393939");" onMouseOut="return nd();"> Диссертация - 480 руб., доставка 10 минут , круглосуточно, без выходных и праздников
Пынзарь Виталий Алексеевич. Особенности лечения рака молочной железы в пожилом и старческом возрасте: диссертация... кандидата медицинских наук: 14.00.27 / Пынзарь Виталий Алексеевич; [Место защиты: ГОУВПО "Российский университет дружбы народов"].- Москва, 2007.- 0 с.: ил.
Введение
Глава 1. Обзор литературы 9
1.1.Актуальность проблемы рака молочной железы у женщин в пожилом возрасте 9
1 2 Особенности онкологических заболеваний у пожилых 10
1 3 Общепринятая тактика лечения рака молочной железы 11
1.4 Виды оперативных вмешательств при раке молочной железы, их эволюция 12
1.5 Нехирургические способы лечебного воздействия 18
1 6 Выбор тактики лечения у больных пожилого возраста 22
Глава 2. Материалы и методы 30
2 1 Техника типичных оперативных вмешательств, выполняемых при раке
молочной железы 31
2 2 Морфологическое изучение операционного материала 38
2.3 Характеристика исследуемой группы больных 41
Глава 3. Анализ проведённого лечения и отдалённых результатов 50
Глава 4. Адъювантиое лечение пожилых больных, неренесшнх оперативное вмешательство 95
4.1. Послеопреационное лечение больных, алгоритм лечения пожилых пациенток 96
Заключение 97
Список литературы 112
Введение к работе
Актуальность темы
Ежегодно в мире регистрируется 8 млн. новых случаев злокачественных новообразований и более 5,2 млн. смертей от них. В России в 2000 г. выявлено 448,6 тыс. больных с впервые в жизни установленным диагнозом злокачественного новообразования.
Продолжительность жизни во многих странах увеличивается, и вместе с этим возрастает заболеваемость злокачественными опухолями пожилых людей (согласно классификации, принятой европейским региональным бюро ВОЗ (Киев, 1963) возраст от 60 до 74 лет признан пожилым, от 75 до 89 -старческим, а 90 лет и более - возрастом долгожителей). За период с 1980 по 2000 год заболеваемость повысилась почти на 70%: с 22,6 до 38,3% 0000 .
В России заболеваемость в возрастных группах после 50 лет резко возросла. На конец 2004 г. на учёте состояло 408,4 тыс. больных РМЖ, из них 55,1% - в течение 5 лет и более (Давыдов М.И., Аксель Е.М., 2005).
Рак молочной железы в России занимает третье место среди всех причин смерти женского населения после болезней системы кровообращения и несчастных случаев во всех возрастных группах, составляя в среднем 2,1%, прогрессивно увеличиваясь с возрастом. Общее число умерших от РМЖ увеличилось с 12,5 тыс. (1983г.) до 22,7 тыс. (2003г.), т.е. прирост составил 10,2 тыс. (85%) (Давыдов М.И., Двойрин В.В., 2005).
Не смотря на очевидную актуальность проблемы, до последнего времени разработке рациональных методов лечения пожилых не уделялось достаточного внимания. Так, в международных научных исследованиях возраст 65-70 лет часто является критерием исключения. По существу, лишь недавно появились специальные научные программы по этой проблеме.
Как известно, онкологические заболевания у пожилых имеют некоторые особенности. Состояние здоровья таких пациентов существенно отличается от больных других возрастных групп, что обусловлено наличием сопутствующих заболеваний (Hillen H.F., Maher ML, Dreyfus H., 2000).
Несомненно, имеются определенные успехи в комбинированном и комплексном лечении рака молочной железы связанные с внедрением в широкую медицинскую практику новых методов лучевой и лекарственной терапии, однако доминирующее значение продолжает занимать хирургическое вмешательство, которое до настоящего времени остается той основой, с учетом которой строится план всех лечебных мероприятий (Иванов В.М. 1993).
Хиругическое лечение всегда должно соответствовать сформулированному в 1960 г. А.И. Раковым принципу онкологического радикализма, который при раке молочной железы предусматривает удаление не только органа с первичной опухолью и окружающими тканями, но также широкое иссечение регионарных лимфатических узлов и клетчатки - первый этап регионарного метастазирования (Баженова А.П., 1983).
Эволюция хирургической тактики привела к постепенному отказу хирургов - онкологов от выполнения калечащих операции типа Урбана -Холдина и предпочтению органо- и функционально-сберегающих вмешательств в сочетании с химио- и лучевой терапией (Иванов В.М., 1993). Однако, постоянно появляющиеся сообщения о возникновении различных серьезных осложений после проведения дистанционной гамма-терапии со стороны органов, попадающих в зону облучения (Кудрявцев Д.В. 2001), ведет к постоянному поиску новых методик облучения и определению более узких показаний к проведению дистанционной лучевой терапии (ДЛТ) на зоны регионарного метастазирования при раке молочной железы, особенно у больных пожилого и старческого возраста.
Благодаря достижениям маммографического скрининга и успехам ранней диагностики рака молочной железы, стало возможно выполнение хирургических вмешательств меньшего объема, что имеет немаловажное значение при лечении рака у пожилых, позволяет добиться быстрой реабилитации оперированных пациентов и улучшить качество их жизни.
Изменение хирургической тактики в сторону органосохранных операций связано и с появлением биологической системной модели рака молочной железы B.Fisher, (1977) показавшей, что данное заболевание на этапе клинической манифестации является системным заболеванием, сопровождающимся скрытой диссеминацией опухолевых клеток. Эта гипотеза сделала необходимым смещение акцента при выборе тактики лечения в сторону системной терапии (Пак Д.Д., 2001).
В настоящее время существует ряд нерешенных проблем, связанных с оптимизацией дальнейшего лечения пожилых пациентов, перенесших органосохраняющие операции. Лучевая терапия несет определенный риск, учитывая наличие сопутствующей патологии. Лекарственная терапия может быть высокоэффективной, хотя ее применение так же проблематично в большинстве случаев, из-за повышенного риска токсичности препаратов. В пожилом возрасте становится значительнее роль гормонотерапии, что определяется более частым содержанием рецепторов эстрогенов и прогестерона в опухоли. При ранних стадиях рака молочной железы у женщин в возрасте старше 70 лет при ЭР+ и/или ПР+ лечение вообще может быть начато с применения тамоксифена (Тюляндин С.А., 2003).
По сути, нет четкого алгоритма лечебной тактики при раке молочной железы у пациентов старшего возраста. Как упоминалось ранее, в международных научных исследованиях возраст пациенток старше 65-70 лет обычно является критерием исключения.
Все вышеизложенное и побудило нас предпринять настоящее исследование особенностей лечения рака молочной железы у пациенток в возрасте 70 лет и старше.
Цель работы
Улучшить результаты лечения рака молочной железы у больных пожилого и старческого возраста за счет разработки алгоритма хирургического и комплексного лечения.
Задачи исследования
Сравнить результаты лечения больных раком молочной железы старше 70 лет при различных объемах оперативного вмешательства.
Определить эффективность послеоперационного лечения в данной возрастной группе с применением адъювантнои терапии и без нее.
Выявить особенности влияния прогностических факторов на общую и безрецидивную выживаемость пациентов в данной возрастной группе.
Изучить по-стадийно трех- и пятилетнюю выживаемость больных раком молочной железы, вошедших в исследуемую группу.
Изучить причины смерти больных раком молочной железы пожилого и старческого возраста.
На основе полученных данных разработать объемы оперативного вмешательства и сформировать алгоритм послеоперационного лечения пациенток, в возрасте 70 лет и старше.
Научная новизна
На собственном клиническом материале изучены результаты лечения пожилых больных раком молочной железы. Произведена сравнительная оценка результатов лечения в зависимости от объема оперативного вмешательства и разработан алгоритм комбинированного и комплексного лечения рака молочной железы в данной возрастной группе.
Практическая ценность
Данное исследование позволяет применять рекомендации по выбору объема оперативного вмешательства и комплексному лечению больных раком молочной железы пожилого возраста; применению адъювантнои эндокринотерапии, что приводит к оптимальной тактике лечения больных раком молочной железы пожилого и старческого возраста.
Основные положения, выносимые на защиту
Оптимальным объёмом оперативного вмешательства при раке молочной железы в стадиях 1-Й, является радикальная резекция, при стадиях III-IV - радикальная мастэктомия с сохранением грудных мышц.
Необходимость проведения дополнительного адъювантного лечения при ранних стадиях рака молочной железы.
При местно-распространённом раке лечение должно быть комплексным, но соответствовать общесоматическому статусу пациента.
При раке молочной железы у пожилых пациенток, факторами, обладающими высокой прогностической значимостью являются: возраст; критерии: Т, N, гормональный статус, центральная локализация опухоли.
Проведение открытой биопсии парастернальных лимфатических узлов является важным элементом операции, позволяющим правильно сталировать заболевание и назначать дополнительную терапию.
При наличии в опухоли положительных рецепторов стероидных гормонов, необходимо назначать гормонотерапию в адъювантном режиме.
Структура смертности больных раком молочной железы в пожилом и старческом возрасте различна в зависимости от стадии заболевания.
Апробация работы
Апробация диссертации состоялась 3 ноября 2006 года на межкафедральной научной конференции с участием сотрудников кафедры общей хирургии, сотрудников Дорожной клинической больницы им. Н.А. Семашко ОАО «РЖД», сотрудников отделения радиохирургии ГУ РОНЦ им. Н.Н. Блохина.
Публикации по теме диссертации
Объем и структура диссертации
Особенности онкологических заболеваний у пожилых
По выявляемости при профилактических осмотрах в России рак молочной железы занимает 4-е место (14,9%) после рака шейки матки (22,7%), губы (15,6%), легкого (15,2%). Среди больных, с впервые в жизни установленным диагнозом, на долю І-ЇІ стадии приходится 56,4%, Ш стадии - 29,6% и IV - 12,6%. Общая пятилетняя выживаемость больных раком молочной железы составляет после радикального лечения от 41 до 65 % .
В отношении продолжительности жизни, пожилые люди без злокачественных опухолей имеют различные перспективы. Так, по средним показателям (учитывая средний возраст в популяции), люди в возрасте 70 лет имеют шанс прожить еще 14 лет, в 80 лет - 7,7 лет, а в 85 лет - 5,4 года
Состояние пожилых больных со злокачественными опухолями существенно отличается от других возрастных групп, что обусловлено, в первую очередь, наличием сопутствующих заболеваний. Так, в возрасте 65 лет и старше только 8% больных со злокачественными опухолями не имеют сопутствующих заболеваний, 37% больных имеют примерно 2 болезни, у 55% больных обычно 3 и более сопутствующие патологии .
У пожилых больных также выявлены некоторые отличительные характеристики и самой опухоли. Так, чаще обнаруживается множественная лекарственная устойчивость, приводящая к снижению эффективности некоторых цитостатических препаратов. С увеличением возраста, опухоль теряет способность к физиологической гибели (апоптозу); обнаружено нарастание гена Вс1-2, препятствующего апоптозу. С другой стороны, с возрастом снижается продукция сосудистого эпителиального фактора роста и опухолевый неоангиогенез. ! го может затруднять рост и метастазирование опухоли .
1.3 Тактика лечения рака молочной железы.
В настоящее время, когда для терапии рака молочной железы (РМЖ) может быть использовано большое количество вариантов лечебных методик, нет другого онкологического заболевания, по вопросу лечения которого существовало бы столько противоречивых мнений . Все многообразие лечебной тактики при РМЖ может быть разделено на 2 условных типа: местное воздействие, включающее хирургическое лечение и лучевую терапию, и системное воздействие (химиотерапия, гормонотерапия). В последние годы активно развиваются дополнительные методы воздействия на опухолевую клетку, разрабатываются новые противоопухолевые агенты, включая иммунотерапию. Изучаются возможности применения адаптогенов, моноклональных антител, ингибиторов неоангиогенеза, ведутся активные разработки генной инженерии. Однако, в настоящее время именно хирургическое лечение считается основным. Весь лечебный план строится на основе проведения оперативного вмешательства с дополнительной терапией .
В последние двадцать лет онкологами, как нашей страны, так и всего мира, разрабатываются альтернативные подходы к лечению больных раком молочной железы, в основе которых лежат органосохраняющие и функционально-щадящие операции, как этап комбинированного и комплексного лечения. Такие операции приобретают особую актуальность при лечении пациенток старше 70 лет. Это связано, в первую очередь, с их общесоматическим состоянием. Известно, что рандомизированные клинические исследования, проведенные в Италии, США, Франции и Англии в 70-80-х гг. при I и II А стадиях рака молочной железы, показали почти одинаковую эффективность органосохраняющего лечения в объеме секторальной резекции молочной железы с подмышечной лимфаденэктомией и лучевой терапией в 60 Гр и мастэктомии по Холстеду. В итальянском исследовании 10-летняя безрецидивная выживаемость больных оказалась одинаковой при органосохраняющем лечении (77%) и мастэктомии по Холстеду (76%) .
В последнее десятилетие углубленное изучение биологических свойств опухоли и внедрение эффективных методов лучевой и хнмиогормональной терапии позволили начать широкое применение органосохраняющего лечения не только при локализованных, но и при местно-распространенных формах рака молочной железы.
Нехирургические способы лечебного воздействия
С 1998 по 2003 гг. на клинических базах кафедры общей хирургии лечебного факультета МГМСУ и в отделении радиохирургии Российского Онкологического Научного Центра им. Н.Н. Блохина РАМН получили оперативное лечение по поводу рака молочной железы более 300 пациенток, в возрасте 70 лет и старше. В группу нашего исследования вошли 272 пациентки, у которых на первом этапе лечения было проведено оперативное вмешательство в том или ином объёме. В ходе предваряющей операцию подготовки и обследования, у всех пациенток было цитологически верифицировано злокачественное опухолевое поражение молочной железы. Учитывая сопутствующую соматическую патологию, больные были осмотрены терапевтом и другими специалистами, при необходимости, получили терапевтическое пособие и предоперационную подготовку. За сутки до операции все были осмотрены анестезиологом.
При том, что объем и продолжительность оперативного вмешательства относительно небольшие, проведение общей анестезии необходимо. Вероятность развития тяжелых, в том числе фатальных, осложнений у таких пациенток обусловлена не столько самой операцией, сколько инвазией и токсичностью анестезии. Многие больные пожилого и старческого возраста страдают тяжелыми сопутствующими заболеваниями и синдромами - такими, как ИБС, гипертоническая болезнь, выраженная недостаточность кровообращения, атеросклероз, политопные аритмии, постинфарктный кардиосклероз, состояние после инсульта, пневмосклероз и тяжелые формы бронхиальной астмы и др. Поэтому в связи с преклонным возрастом и выраженными сопутствующими заболеваниями, им часто отказывают в хирургическом, а в последующем - лучевом и химиотерапевтическом лечении. Появившиеся новые методы мониторинга и лекарственные препараты для анестезии значительно расшили показания к оперативному лечению. 2.1 Техника типичных оперативных вмешательств, выполняемых при раке молочной железы.
Анестезиологическое пособие. Важное значение имеет премедикация, дозировка которой у пожилых пациентов должна быть снижена. С противорвотной целью перед анестезией внутривенно вводится дексаметазон (4 мг) и метоклопрамид (25 мг). Для достижения достаточной, и в то же время управляемой, анестезии, у этих больных целесообразно применение многокомпонентной комбинированной анестезии. Использование гортанной маски позволяет обойтись без интубации трахеи. При минимальной инвазии, гортанная маска обеспечивает надежную искусственную вентиляцию легких и спонтанное дыхание. Это позволяет отказаться от деполяризующих миорелаксантов. Комбинация внутривенного и ингаляционного компонентов с использованием короткодействующих анестетиков и миорелаксантов (фентанил, пропофол, изофлюран, цисатракуриум) позволяет значительно (более чем в 2 раза) уменьшить их дозы и уверенно контролировать глубину анестезии на различных этапах операции. Следует особо отметить свойство пропофола быстро потенцировать общую анестезию на короткое время, что делает его очень удобным для усиления обезболивания на травматичных этапах операции и в то же время способствует скорейшему восстановлению адекватного сознания и самостоятельного дыхания. Свойство пропофола значительно замедлять сердечный ритм обычно проявляется при вводной анестезии, в большинстве случаев оно нивелируется медленным дробным введением небольших доз (10 мг) или добавлением атропина и не является абсолютным противопоказанием у больных с исходной брадикардией. Анестезия поддерживается по методике комбинированной нейролептаналгезии. Дыхание осуществляется аппаратом ИВЛ в соотношении N20: 02 - 1: 1. Техника операции. При раке молочной железы типичными оперативными вмешательствами являются радикальная мастзктомия с сохранением грудных мышц и радикальная резекция молочной железы. Следует отметить, что в случае радикальной резекции, открытая биопсия возможна только при внутреннем или центральном расположении первичной опухоли. Положение больной на операционном столе типичное - на спине с разведенными руками. I. Радикальная мастзктомия.
При выполнении мастэктомии производится два полуовальных разреза, окаймляющих молочную железу в поперечном направлении. Рис. 1. Вид операционного поля в начале выполнения радикальной мастэктомии справа. Верхний и нижний кожные лоскуты отсепаровываются с целью максимальной мобильности для ушивания операционной раны. Начиная с медиального края, электроножом, молочная железа с фасцией отделяется от большой грудной мышцы до наружнего края последней. Препарат отводится в латеральном направлении. Также электрохнрургически пересекается фасция Жерди, после чего визуализируется подмышечный сосудистый пучок. Производится выделение жировой клетчатки с подмышечными лимфатическими узлами. Рис. 2 Вид операционного поля по окончании основного этапа операции.
С наружной стороны кожный лоскут раны отсепаровывается до края широчайшей мышцы спины. Освобождаются от окружающей клетчатки подлопаточные сосуды и нервы. Далее, ассистенты крючками Фарабефа поднимают края большой грудной мышцы. Выделяется межпекторальная клетчатка, малая грудная мышца смещается латерально для облегчения доступа к апикальной группе подключичных лимфоузлов Острым путем производится удаление всей клетчатки с лимфоузлами из пространства Лисфранка. Затем малую и большую грудные мышцы отводят кверху для удаления лимфоузлов подключичной области. Мелкие сосуды, отходящие от подключичной вены, коагулируют, пересекается межреберно-плечевой нерв у межреберной мышцы. Длинный грудной нерв освобождается от клетчатки и сохраняется. Таким образом, производится удаление молочной железы в едином блоке с межпекторалъными, поключячнымн, подмышечными и подлапаточными лимфатическими узлами.
Характеристика исследуемой группы больных
В 132 случаях оперативное вмешательство было дополнено открытой биопсией парастернальных лимфатических узлов на стороне поражённой молочной железы по ранее описанной методике. Метастатическое поражение парастернальных лимфатических узлов, что соответствует критерию pN3b, выявлено и гистологически подтверждено только у пациенток с метастазами в подмышечные лнмфатическиие узлы (9 из 67). У 65 пациенток при отсутствии метастатического поражения подмышечных лимфатических узлов, наличия метастазов в парастерналъные лимфатические узлы не выявлено.
Пациентки с наличием критерия pN3b распределились по отношению к критерию рТ и количеству подмышечных лимфатических узлов {критерии N2a, N3a) следующим образом: T1N1 - 1 случай, T2N1 - 3 случая, T2N3a - 1 наблюдение, T3N1 - 2 наблюдения, T3N2a - 1 случай, T4N2a - 1 случай. По локализации первичной опухоли в молочной железе, эти 9 случаев распределились так: у 5 пациенток опухоль располагалась в наружных квадрантах, у 2-х занимала место в центральном квадранте, а ещё в 2-х случаях опухоль располагалась во внутренних квадрантах.
Интересным наблюдением является то, что по данному распределению можно видеть, что в нашей выборке частота появления метастазов в парастернальной зоне никак не связана с количеством выявленных поражённых аксиллярных лимфатических узлов.
Влияние открытой биопсии парастернальных лимфатических узлов на стороне поражённой молочной железы на принятие решения о дальнейшей тактике лечения видно даже на нашей относительно небольшой выборке пациенток. В вышеописанных 9 случаях, при выявлении метастатического поражения парастернальных лимфатических узлов, были скорректированы стадии заболевания у пациенток и назначено соответствующее дополнительное лечение, с учетом показателя pN3b, локализации первичной опухоли в молочной железе, а именно: послеоперационная ДЛТ на зоны регионарного метастазирования была дополнена полем на область парастерналъной цепочки. Особо важной данная манипуляция оказалась для тех 5 пациенток, у которых опухоль располагалась в наружных квадрантах, так как при локализации опухоли в центральном или внутреннем квадранте ДЛТ проводится и на парастернальную зону, а при наружной локализации первичной опухоли - нет. В нашем случае, проведя открытую биопсию, мы доказали необходимость в этих 5 случаях проведения послеоперационной дистанционной лучевой терапии на парастернальную зону.
Таким образом, при назначении ДЛТ, когда не было выявлено метастазов в регионарные лимфатические узлы, мы принимали во внимание значение рТ, а при их наличии, основой для назначения послеоперационной ДЛТ служил именно показатель pN.
Для дальнейшего определения отдалённых результатов лечения (сроков выживаемости, рецидивнрования), наблюдаемые пациентки (за исключением Зх случаев рака Педжета) были разделены на две основные группы: первая группа больных после выполнения мастэктомии, вторая группа - после выполнения радикальной резекции. Внутри каждая группа была разделена по наличию или отсутствию метастатического поражения аксиллярных лимфатических узлов.
Необходимо отметить, что пациенткам с наличием критерия первичной опухоли рТ1-2 в группах с позитивными и негативными аксиллярными лимфатическими узлами выполнялись как радикальные резекции, так и мастэктомии, а при наличии критерии рТ 3-4 выполнялись исключительно радикальные мастэктомии.
По назначению послеоперационной ДЛТ, больные распределились следующим образом: лучевая терапия выполнялась при метастатически поражённых аксиллярных лимфатических узлах в случае выполнения мастэктомии - в 7 наблюдениях, при выполнении радикальной резекции - в 21 случае. Назначение ДЛТ при не пораженных аксиллярных лимфатических узлах после выполнения радикальной мастэктомии не проводилось при рТ1-2 и в 4 случаях назначалось при рТ4 (эти случаи вошли в группу пациенток с критерием рТЗ-4), а при радикальной резекции, послеоперационная дистанционная лучевая терапия назначалась в 39 случаях (таблица 15). Распределение назначения послеоперационной дистанционной лучевой терапии (ДЛТ) при различных объёмах оперативного вмешательства на молочной железе при наличии или отсутствии метастатического поражения регионарных лимфатических узлов представлено в таблице 15.
Послеопреационное лечение больных, алгоритм лечения пожилых пациенток
При анализе данных таблицы, выявляется, что при I стадии химиотерапевтическое лечение не назначалось вообще, в 61% случаев проводилось гормонотерапия, а в 39% - больным системная терапия не проводилась. При II стадии гормональное лечение назначалось примерно в той же частоте: в 57,4% случаев, никакой системной терапии не проводилось в 38% случаев, но уже имело место назначение ПХТ в 4,7% случаев. При III же стадии заболевания наиболее часто применялась гормонотерапия в 54,2% случаев, химиотерапевтическое лечение становится значимым и назначается уже в 27,1% случаев, а без системной терапии остались лишь 18,6% пациенток. Таким образом, гормонотерапия при всех стадиях заболевания у данного контингента больных была наиболее часто использована. Химиотерапевтическое лечение используется тем чаще, чем выше стадия заболевания. При увеличении стадии заболевания, уменьшается количество пациенток, у которых имеется возможность обойтись без системной терапии.
Важнейшим критерием, характеризующим правильность проводимого лечения, являются показатели общей и безрецидивной выживаемости, достигнутые при проведении данной терапии (таблица 39 и 40).
При анализе общей выживаемости, в зависимости от проводимой системной терапии, выявляется, что при I и II стадиях рака молочной железы проводимая системная терапия не оказывала статистически значимого влияния (р 0,2) на результаты 3- и 5- летней общей выживаемости. При анализе общей выживаемости при ПТ стадии рака, имеется статистически значимое (р=0,009) различие показателей 3- и 5-летней общей выживаемости между группой из 11 больных, которым не проводилось дополнительной системной терапии 27,3±13,4 и 9,1±8,7 соответственно, по сравнению с 3- и 5- летней выживаемостью в группе из 32 больных с гормонотерапией 66,3±8,8 и 47,6±10,2 соответственно.
А при сравнении 3- и 5- летней выживаемости в группе из 11 больных без системной терапии с группой больных из 16 человек, которым применялась химиотерапевтическое лечение, имеется статистически не значимое (р=0,298), но заметное снижение показателей 3- и 5- летней общей выживаемости, у больных без системной терапии 27,3±13,4 и 9,1±8,7 соответственно, чем у больных, которым проводилась ПХТ -43,8±12,4 и 26,3±12,1 соответственно.
При анализе данных безрецидивной выживаемости по-стадийно, в зависимости от проводимой системной терапии, выявляется, что при всех изученных нами стадиях рака молочной железы, проводимая системная терапия не оказывала статистически значимого влияния (все р 0,2) на результаты 3- и 5- летней безрецидивной выживаемости.
Вывод: Проводимая в послеоперационном периоде системная терапия, не оказывает статистически значимого влияния на показатели 3- и 5-летней общей и безрецидивной выживаемости у исследуемой группы больных при I и II стадиях. Однако, отказ от проведения системной терапии при 111 стадии рака молочной железы, оказывает статистически значимое влияние (р=0,009) на обитую выживаемость и приводит к значительному снижению показателей выживаемости. При отказе от системной терапии при III стадии, показатели трёх и пятилетней общей выживаемости составили 27,3+13,4 и 9,1+8,7 соответственно, по сравнению с показателями 3- и 5- летней общей выживаемости в группе больных, которым проводилась гормонотерапия 66,3±8,8 и 47,6±10,2 соответственно.
В послеоперационном периоде применяется комплекс лечебных мероприятий, включающий в себя как системную терапию, так и местное воздействие. Распределение терапии представлено в таблице 41.
После проведённого оперативного лечения, в большинстве случаев (41,5%), пациентки получали исключительно гормонотерапию, никакого дополнительного лечения не получали 26% пациенток. В плане комбинированного лечения (операция+ДЛТ), лучевая терапия применялась у 7,9% пациенток; химиотерапевтическое воздействие в качестве монотерапии применялось у 3% больных. Комбинированное лечение (операция+ДЛТ+ХТ) получали 1,1% пациенток. Комбинацию ДЛТ+ гормонотерапия применяли в 16,2% случаев, а системное воздействие в виде химиотерапевтического лечения с дальнейшим назначением гормонотерапии использовали в 3% случаев. Полный комплекс воздействия, включающий в себя послеоперационную лучевую терапию. химиотерапевтическое лечение с дальнейшим назначением гормонотерапии применялся в 1,1% случаев. При анализе того же лечения, но покггадийно, отмечаются следующие тенденции: при всех описанных стадиях, ведущим методом является гормонотерапия (в среднем в 40-43% случаев), комбинированный метод лечения (операция+ДЛТ) применяется в случае радикальных резекций (1-І! стадии) в среднем в 10,2% случаев. Комбинация же ДЛТ + гормонотерапия применима наиболее часто и при всех стадиях (16,2%) Химиотерапевтическое воздействие, как самостоятельный вид лечения, так и в комплексе с другими видами воздействия применяется тем чаще, чем выше стадия заболевания. Отказ от проведения какого-либо дополнительного лечения был возможен при I-II стадиях лишь в 28,2 % случаев, в то время как при Ш стадии заболевания, это было возможно значительно реже, лишь в 18,6% случаев.
При своевременной диагностике рак излечим. Сейчас в мире живет около 5 млн человек, излеченных от рака, в том числе стариков. Даже в преклонном возрасте и при более позднем выявлении рака адекватное лечение позволяет задержать прогрессирование процесса, устранить осложнения и облегчить страдания, а правильно организованные помощь и уход - снизить остроту многих социальных и бытовых проблем.
В основе выбора метода лечения онкологического больного лежат точно установленный диагноз, локализация, морфология и распространенность опухолевого процесса. Лечение в большей степени зависит от биологических особенностей, формы и темпа роста опухоли, а также от возраста больного, сопутствующих заболеваний, функциональных возможностей и резервов стареющего организма.
Лечение злокачественных новообразований должно начинаться не позднее 7-10-го дня от момента установления диагноза и определения тяжести состояния больного.
Различают радикальное, паллиативное и симптоматическое лечение. Радикальное лечение направлено на удаление всех очагов опухолевого роста. Целью паллиативного лечения является уменьшение опухоли и задержка ее роста при невозможности полного излечения. Симптоматическое лечение устраняет тягостные для больного проявления заболевания или его осложнения.
При лечении злокачественных опухолей применяют хирургический, лучевой и химиотерапевтический методы. В качестве сопутствующего используют иммунобиологическое и гормональное лечение. Один метод лечения, как правило, бывает радикальным только на самых ранних стадиях рака. Чаще применяют сочетание нескольких видов воздействия, например лучевого и химиотерапевтического. Комплексное лечение включает все методы воздействия - хирургическое, лучевое, лекарственное, гормональное и др. Лечение считают комбинированным, если используют хирургическое вмешательство и один из дополнительных методов (химиотерапия или лучевая терапия).
По данным, приводимым В.И.
Чиссовым, В.В. Старинским, Б.Н. Ковалевым, доля основных методов лечения со временем существенно не меняется (хирургический метод в 1950 г. составил 35%, в 1998 г. - 41,1%; комбинированный метод в 1950 г. - 21,6%, в 1998 г. - 27,0%), что говорит об оправданности и обоснованности показаний к их применению при несомненном росте методического уровня лечения и лучшей технической оснащенности лечебного процесса. Острейшей медико-социальной и деонтоло-гической проблемой остаются отказы онкологических больных от лечения. На протяжении последних 20 лет около 5,9% больных, подлежащих специальному лечению, отказывались от него. Каждый 4-й такой больной имел I- II стадию опухолевого процесса.
Если в 1950 г. в России насчитывалось 5900 коек для лечения онкологических больных, то к 1998 г. их число возросло в 6,4 раза, составив 38 000 онкологических и радиологических коек в 115 специализированных диспансерах.
В то же время число онкологических больных, подлежащих лечению, увеличилось в 12,7 раза. В этих условиях необходимо углубление представлений врачей общей сети о принципах лечения опухолей, тем более что значительная часть пожилых больных проходит лечение вне специализированных стационаров. Врачи поликлиник осуществляют наблюдение за состоянием больных на дому, проводят реабилитационные мероприятия по завершении специального лечения того или иного вида и осуществляют симптоматическую терапию по рекомендации онколога.
Хирургическое лечение
Основным методом лечения злокачественных новообразований остается хирургический. Совершенствование хирургических операций, достижения анестезиологии и реаниматологии свели к минимуму противопоказания к хирургическому лечению злокачественных опухолей у больных пожилого и старческого возраста. Показания к операции расширяют и органо-сохраняющие вмешательства (например, сегментили зонэктомия при раке легких на фоне дыхательной недостаточности и т. д.).
В зависимости от распространенности опухолевого процесса хирургические операции могут быть радикальными, паллиативными или симптоматическими. Основные принципы онкохирургии представляют абластичность, атравматичность, футлярность и радикализм. Первые три принципа обеспечиваются предварительной перевязкой сосудов, удалением органа в его фасциальных влагалищах единым блоком со связочным аппаратом и региональными лимфатическими узлами, что позволяет избежать имплантационного и гематогенного метастазирования. Радикализм связан с правильным выбором вида операции и подтверждается срочным гистологическим исследованием лимфатических узлов или края резецированного органа.
Не следует исповедовать принцип «малая опухоль - большая операция, большая опухоль - малая операция», а также стремиться к сверхрадикализму. Определенному поражению должно соответствовать адекватное лечение. Так, при I стадии опухоль можно удалить местнорадикальным методом. Резекция, т. е. удаление части органа с сохранением его физиологических функций, возможна при II стадии заболевания. При раке III стадии орган удаляют полностью (экстирпация или эктомия) со связочным и лимфатическим аппаратом. При расширенных операциях удаляют вовлеченные в процесс соседние органы, а при комбинированных - и органы, не связанные с распространением ракового процесса.
Паллиативные операции - это удаление первичной опухоли при отдаленных метастазах, частичное удаление опухоли в расчете на дальнейшее химиотерапевтическое воздействие. Паллиативные операции нередко бывают вынужденными из-за тяжести сопутствующих заболеваний и старческого возраста пациента. Симптоматические операции показаны при множественных метастазах, прорастании опухоли в соседние жизненно важные органы, выраженных нарушениях функции органа, кровотечениях, распадающейся опухоли. В любом случае при планировании операции у стариков необходимо тщательно сопоставить риск осложнений операции и тот эффект, которого можно достичь в результате операции и с помощью других методов лечения.
Лучевая терапия
Более 70% онкологических больных нуждаются в лучевом лечении и 40% из них могут быть вылечены только лучевым методом (рак кожи, нижней губы, шейки матки и др.).
В комбинации с хирургическим вмешательством радиационные методы уменьшают риск рецидивов опухоли и повышают радикализм операции. Лучевые воздействия девитализируют клетки, инкапсулируют комплексы раковых клеток, способствуют облитерации мелких сосудов, задерживая передвижение раковых эмболов, уменьшают воспалительные явления, переводя неоперабельную опухоль в операбельную. В основе действия лучевых агентов лежит повреждение хромосом клетки злокачественной опухоли.
К сожалению, лучевые методы чаще применяют с паллиативной целью. Облучение замедляет роста опухоли, уменьшает боли, продлевает жизнь больного. Вместе с тем лучевые воздействия чреваты многими осложнениями. Имеются достаточно веские противопоказания к использованию лучевых методов - анемия, лейкопения, сердечно-легочная и почечная недостаточность, психические расстройства, кровотечения, угроза перфорации опухоли и др. Ранние осложнения: ожоги кожи и слизистых оболочек, язвы, геморрагический цистит, уретрит, колит; поздние: гемангиэктазии, фиброз тканей, хронические язвы, псевдоопухоли, невриты, свищи, остеопороз, переломы костей, энтероколиты и др.; генетические: индуцированные злокачественные опухоли - рак, саркома, лейкозы.
Возможно контактное облучение аппликационным, внутритканевым или внутриполостным способами, когда источники излучения подводят непосредственно к опухоли. Так лечат рак тела и шейки матки, мочевого пузыря, полости рта, прямой кишки, пищевода и т. д.
Более распространен дистанционный метод лучевой терапии с использованием коротко-или длиннофокусных рентгеновских аппаратов, ускорителей электронов или тяжелых заряженных частиц, гамма-, бета- и нейтронного излучения и их сочетаний для глубоко расположенных опухолей. Лечебные дозы колеблются в пределах от 20 до 80 Гр в зависимости от цели (радикальное, сочетанное или комбинированное лечение), а также от радиочувствительности тканей опухоли и состояния больного.
Программу лучевого лечения строят индивидуально в зависимости от морфологии, глубины расположения, распространенности опухолевого процесса и анатомо-топографических данных. Вид источника, поля облучения, дозы фракции и интервалы должны быть определены математически с использованием вычислительной техники. Для повышения эффективности ионизирующих воздействий используют гипербарическую оксигенацию, гипертермию, некоторые антимитотические антибиотики и др. Особенно осторожно следует назначать лучевое лечение пожилым больным, у которых осложнения развиваются наиболее часто.
Лекарственная терапия
Противоопухолевые химические препараты применяют в течение последних 50 лет. Они делятся на препараты с цитотоксическими или цитолитическими свойствами и гормональные препараты. Химиопрепараты токсичны не только для раковой, но и для любой другой клетки организма, что делает их применение весьма серьезной проблемой. По словам Н.Н. Блохина, «мы можем преодолеть рак в любом периоде его развития - организм больного не выдерживает».
Противоопухолевые препараты используют в виде моноили полихимиотерапии. Одновременно или последовательно применяют препараты различного действия. Химиотерапию можно использовать как компонент комбинированного или комплексного лечения (адъювантная или дополнительная терапия). В последнее время применяют неоадъювантную химиотерапию, предшествующую хирургическому или лучевому лечению. При ней можно уменьшить объем опухоли и повысить радикальность последующего лечения.
Химиопрепараты вводят внутримышечно, внутривенно, внутриартериально, эндолимфатически, в полости и непосредственно в опухоль, а также назначают внутрь. Препараты применяют в предоперационном периоде, во время операции, после паллиативных и радикальных вмешательств.
Химиотерапия наиболее эффективна при хроническом миелолейкозе, ретинобластоме, полицитемии, лимфогранулематозе, лимфосар-коме, ретикулосаркоме, хроническом лимфолейкозе, опухолях яичка. Менее чуствительны к цитостатикам острый миелолейкоз, миелома, нейробластома. Успешно, но в основном в паллиативном плане применяют химиотерапию при мелкоклеточном раке легкого, раке яичников, молочной железы, недифференцированном раке носоглотки, раке гортани, инсуломе, саркомах мягких тканей и костей и др. Химиотерапевтические препараты не дают особого эффекта при раке желудка, толстой и прямой кишок, раке печени и др.
Химиотерапия сопровождается рядом серьезных осложнений, которые по срокам возникновения делят на непосредственные, возникающие в первые часы после введения препарата (тошнота, рвота); ближайшие, возникающие во второй половине курса или через 1-2 нед по его окончании; отсроченные, проявляющиеся через 3-6 нед после лечения, и отдаленные, возникающие спустя годы, когда реализуется их канцерогенный эффект.
Побочные эффекты химиопрепаратов сказываются в основном на пролиферирующих тканях - костном мозге, лимфатической системе, эпителии полости рта и желудочно-кишечного тракта, коже и др. Это выражается в депрессии костного мозга, диспепсических синдромах, облысении, подавлении гуморального и клеточного иммунитета, функции репродуктивных органов и др.
В пожилом возрасте требуется особая осторожность при назначении химиопрепаратов. Снижают начальные дозы, увеличивают интервалы между введениями препаратов, обеспечивают строгий лабораторный контроль, особенно при почечной, сердечной и коронарной недостаточности, аритмиях, нарушениях сердечной проводимости, функции печени, атонических запорах. Лекарственное противоопухолевое лечение противопоказано при кахексии, обезвоживании, плеврите (неопухолевой природы), лихорадке, сопутствующих инфекциях. Применение гормонотерапии ограничено небольшим числом гормонозависимых опухолей (рак молочной железы, предстательной железы, тела матки).
Критерием излеченности онкологического больного является время. Здоровым считается пациент, у которого в течение 5 лет после лечения не возникло рецидивов заболевания. Одним из важнейших показателей эффективности лечения служит увеличение числа излеченных больных. Так, за последние 10 лет число больных, излеченных от рака трахеи, бронхов и легкого, увеличилось с 20,2 до 31,5%, от рака прямой кишки - с 46,3 до 53,3%, от рака полости рта и глотки - с 39,7 до 46,9%, от злокачественных лимфом - с 41,2 до 52,0% и т.д.
Менее продолжительные сроки удовлетворительного состояния человека после радикальной операции или комплексного лечения считают ремиссией. Длительность безрецидивных периодов колеблется от нескольких месяцев до 2-3 лет. Сохранение и нарастание симптомов раковой опухоли, несмотря на радикальное лечение, указывает на прогрессирование раковой болезни. Оно может быть следствием местного продолженного роста опухоли или диссеминации процесса. Другой форме прогрессирования рака - местному рецидиву свойственна длительная ремиссия, но спустя 5-6 мес, а иногда и позже вновь появляются признаки опухолевого роста на месте удаленного новообразования.Местный рецидив может быть в тканях ложа опухоли или в культе удаленного органа, нередко свидетельствуя о неадекватно выбранном объеме операции, отсутствии или недостаточности применения дополнительных методов лечения. В течение 1-го года после лечения рецидивы возникают в 70% случаев, в течение 2-го - в 20%, в течение 3-го - в 5-10%. Более поздние сроки становятся редким исключением. Все это требует регулярного диспансерного наблюдения за больными, особенно в течение 1-го года после операции, когда повторное хирургическое вмешательство может привести к излечению.
Более поздние рецидивы следует рассматривать как возможную метахронную самостоятельную опухоль. Если удается доказать самостоятельность новой опухоли, лечение следует проводить соответственно стадии нового процесса и по возможности избегать воздействия индуцирующих факторов.
Метастазы в отдаленные органы (без местного рецидива) дают о себе знать несколько позже. Их число возрастает к 3-4-му году и снижается к 5-му. Одним из редких исключений является рак молочной железы, когда после ремиссии, длящейся 5-10 лет и более, иногда выявляются отдаленные метастазы.
Ранняя диагностика, совершенствование хирургических вмешательств, использование комбинированной и комплексной терапии опухолей позволили значительно улучшить результаты лечения. Помимо увеличения числа излеченных больных, эффективность лечения оценивается в соответствии с приводимыми И.В. Поддубной и соавт. критериями ВОЗ, характеризующими изменения объективного статуса и субъективного состояния онкологического больного.
Объективный эффект оценивается следующим образом:
полная ремиссия - полное исчезновение всех клинических и лабораторных проявлений опухолевого заболевания на срок не менее 4 нед;
частичная ремиссия - уменьшение всех измеряемых опухолей не менее чем на 50% на срок не менее 4 нед;
стабилизация - уменьшение менее чем на 50% при отсутствии новых поражений или увеличение опухолевых очагов не более чем на 25%;
прогрессирование - увеличение размеров опухолей на 25% и более и/или появление новых очагов поражения.
Для опухолей некоторых локализаций, например для метастазов в кости, разработаны самостоятельные критерии оценки эффективности лечения. Полная регрессия - полное исчезновение всех поражений на рентгенограммах или томограммах; частичный эффект - частичное уменьшение остеолитических метастазов, их рекальцификация или уменьшение плотности остеобластных поражений; стабилизация - отсутствие изменений в течение 8 нед от начала лечения; прогрессирование - увеличение существующих или появление новых поражений.
При оценке объективного эффекта необходимо учитывать также динамику биохимических и иммунологических маркеров. Важными показателями эффективности являются частота рецидивов, длительность ремиссии и выживаемость больных.
Субъективный эффект оценивают по изменению статуса, уменьшению или исчезновению болей и изменению массы тела. Общее состояние больного оценивают до начала лечения, в процессе и после его окончания по 5-степенной системе:
0 - полностью активен, способен выполнять работу, которую осуществлял до болезни, без ограничений;
1 - испытывает трудности при выполнении физической или напряженной работы. Способен выполнять легкую или сидячую работу;
2 - обслуживает себя полностью, но не способен работать по специальности. Большую часть дневного времени проводит не в постели;
3 - обслуживает себя с ограничениями. Более 50% времени проводит лежа;
4 - полная инвалидность. Не способен обслуживать себя, прикован к постели.
Возможна характеристика болевого синдрома, аппетита и функции органов по шкале Карновского: 0 - нет симптомов; 1 - умеренные симптомы; 2 - симптомы средней выраженности; 3 - тяжелые симптомы; 4 - особо тяжелые симптомы, угрожающие жизни. Улучшение результатов лечения злокачественных опухолей способствует и продлению жизни больных. Средняя продолжительность предстоящей жизни 60-летних мужчин, заболевших злокачественными новообразованиями, увеличилась в среднем на 4,6 года, а 60-летних женщин - на 10,2 года.























